Las
sustancias están constituidas por más de una clase de átomos, es decir, por más
de un elemento químico. La fuerza que mantiene unidos a los átomos se llama UNIÓN
QUÍMCA.
¿PORQUÉ SE UNEN LOS ÁTOMOS?
Los átomos
se unen entre sí para estabilizarse, ¿Cómo explicar cuando son estables?: cuando
los átomos no tienen tendencia a romper la fuerza que los mantiene unidos.
Si los
átomos están unidos en forma estable, las sustancias que los constituyen son
estables.
Por ejemplo:
Ø H2O es
una sustancia estable que no tiene tendencia a transformarse en otra, debido a
que los átomos de Hidrogeno y Oxigeno se unen entre si y se estabilizan
formando la molécula del agua.
Ø Fe2O3, el Hierro es un elemento que en presencia de Oxigeno
tiende a reaccionar químicamente formando el “Óxido férrico”, se dice entonces
que los átomos de hierro son más estables cuando están unidos al Oxígeno que
cuando no lo están.
En la
tabla periódica encontramos el grupo 18 o VIII (A) de los “Gases Nobles”. estos
elementos tienen su ultimo nivel de energía completo con 8 electrones, a excepción
del Helio que tiene solo 2 electrones, por lo que no pueden formar uniones químicas,
de aquí nace la Regla del Octeto: “para que los átomos sean estables deben
poseer 8 electrones en su último nivel de energía, asemejándose al gas noble más
próximo”. El resto de los
elementos de la tabla contienen menos de 8 electrones de manera que son inestables,
esto hace que elementos de carácter metálico tengan tendencia a ceder
electrones para estabilizarse y los de carácter no metálicos reciban o capten
electrones para que cada uno se estabilice.
Para realizar el esquema de las distintas uniones se utiliza
el diagrama de Lewis donde los electrones que participan de las uniones se
denominan electrones de valencia y son los que se encuentran en la capa mas externa
del átomo. El número de electrones coincide con el número de grupo al que
pertenece el elemento en la tabla periódica.
En los
diagramas de Lewis, los electrones se simbolizan con puntos o cruces, lo que
permite ver no solo los electrones de valencia que participan, sino que pasa durante
la formación de la unión química.
TIPO DE
UNIONES
Ø UNIÓN IÓNICA: se da en compuestos formados por
un elemento metálico y un elemento no metálico. La característica de los
metales es que tienen tendencia a perder electrones de su último nivel de energía
para lograr la estabilización y la de los no metales es de captar electrones para
completar el último nivel para llegar al octeto. Por lo que en estos compuestos
se forman iones positivos llamados cationes correspondientes a los metales e iones
negativos llamados aniones que corresponden al no metal.
Por ejemplo, el óxido de calcio CaO
Ø UNIÓN COVALENTE: se da en compuestos formados
por dos o mas no metales. Como los no metales no pueden ceder electrones por su
característica, comparten electrones de su último nivel de energía hasta
adquirir la configuración electrónica del gas noble mas cercano.
Por ejemplo, la molécula de cloro Cl2
formada por dos átomos de cloro cada uno tiene 7 electrones en su último nivel
de energía
CLASIFICACIÓN DE UNIÓN COVALENTE
Si se
comparten un solo par de electrones se denomina unión covalente simple como el caso de arriba. Si se comparten dos
pares de electrones se denomina covalente
doble, con tres pares de electrones se llama covalente triple. También existe la que se denomina dativa o coordinada es la que uno solo
de los elementos comparte el par de electrones.
En conclusión, los enlaces químicos están hechos de manera que los átomos puedan tener su capa externa completa, esto significa que tengan una configuración electrónica estable. En el enlace iónico, cuando el átomo metálico tiene un sólo electrón en su capa externa y el no-metálico necesita de un electrón para completar su capa; el átomo metálico sede su electrón al no-metálico. Del mismo modo, en el enlace covalente se comparte el electrón para así lograr el equilibrio.
NOTA: podemos ampliar el tema visto visitando videos tutoriales.
PRÁCTICA ÁULICA
CLASE N.º 1 (Duración 80 minutos)
ACTIVIDAD DE
INICIO
1. Indagación de conceptos previos a través de lluvia de ideas. (tiempo aproximado 30 minutos)
Preguntas escritas en el pizarrón:
·
¿Qué metales conocen?
·
¿Qué no metales
conocen?
·
¿Qué características
presentan los metales?
·
¿Qué características
presentan los no metales?
·
Observe la fórmula
de la siguiente sustancia: ClNa (cloruro
de sodio)
·
Clasificar, con
ayuda de la tabla periódica, los elementos que componen el cloruro de sodio, en
metal y no metal.
·
Observe la fórmula de la siguiente sustancia: CO2
(dióxido de carbono)
·
Clasificar, con
ayuda de la tabla periódica, los elementos que componen el dióxido de carbono.
Las respuestas se escribirán en el pizarrón.
ACTIVIDAD DE
DESARROLLO
2. Leer del cuadernillo de química las páginas 7,
8 y 9 referido a “Uniones Químicas” (tiempo estimado 10 minutos)
3.
Después de la
lectura marcar las ideas principales. (tiempo
estimado 10 minutos)
4.
Responder el
siguiente cuestionario: (tiempo estimado 20
minutos)
a) ¿Cómo se llama la fuerza que mantiene unidos a
los átomos?
b) Defina la regla del octeto.
c) Escriba la configuración electrónica de los
siguientes elementos: Br, Ca, N2, Al
d) Determine la cantidad de electrones que presentan
en su último nivel de energía.
e) Represente el diagrama de Lewis de los
elementos antes mencionados teniendo en cuenta los electrones del último nivel
de energía.
ACTIVIDAD DE CIERRE
Debatir las respuestas. (tiempo estimado 10 minutos)
CLASE N.º 2 (Duración 80 minutos)
ACTIVIDAD DE
INICIO
1. Retomar las respuestas de la clase anterior y
volver a debatir (tiempo estimado 15 minutos)
ACTIVIDAD DE
DESARROLLO
2. La profesora presenta un ejercicio de uniones
en el pizarrón y explica el procedimiento (tiempo estimado 15 minutos)
Ejemplo:
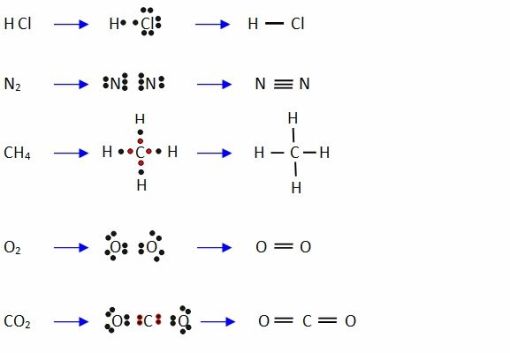
Los alumnos desarrollan ejercitación escrita
de manera grupal (tiempo estimado 40 minutos)
a) Observar los siguientes compuestos inorgánicos:
CaO - MgO - N2O3 - I2 - N2 - S3Al2
b) Clasificar los compuestos del punto anterior
en iónicos y covalentes.
c) Desarrollar la configuración electrónica de
cada uno de los elementos de los compuestos anteriores.
d) Determinar la cantidad de electrones del último
nivel de energía de cada uno de ellos.
e) Desarrollar las respectivas uniones.
ACTIVIDAD DE CIERRE
4. Se repasa en forma oral la mecánica del
desarrollo de las uniones. (tiempo estimado 10 minutos)
CLASE
N.º 3 (Duración de la clase 80 minutos)
ACTIVIDAD DE INICIO (tiempo estimado 20 minutos)
1. Se retoma la charla de la clase anterior para
repasar lo visto.
ACTIVIDAD DE DESARROLLO
2. Se observa un video tutorial sobre la temática
para aclarar alguna duda al respecto. (duración aproximada 20 minutos)
3. Se debate sobre lo visto en el video y se sacan
conclusiones (tiempo estimado 20 minutos)
4. Se propone a los alumnos comiencen el desarrollo
de un trabajo de investigación de manera grupal sobre compuestos iónicos y
covalentes conocidos y/o utilizados diariamente utilizando internet. Continuándose
en el hogar.
CLASE
N.º 4 (Duración de la clase 80 minutos)
ACTIVIDAD DE INICIO (tiempo aproximado 20 minutos)
1. Repaso de lo visto la clase anterior del
video.
ACTIVIDAD DE DESARROLLO (tiempo 50 minutos)
2. Exposición de los trabajos de investigación por
grupos.
ACTIVIDAD DE CIERRE
3. Sacamos conclusiones de lo expuesto y realizar un mapa conceptual de todo lo visto.